細胞の増殖・形態変化・傷害率をリアルタイムで 経時的に測定︕
セルベースアッセイは組織や動物実験と⽐較して、コスト⾯・スループット性において優位性があるため広範に使⽤されています。 しかしながら、多くの場合はある1点での測定に限定され、経時的な変化を評価することは困難です。Axion BioSystems社の Maestro Zは培養細胞のインピーダンスの変化をラベルフリー、リアルタイム、且つ継続して測定します。このような経時的なデー タ測定により、細胞間相互作⽤や各種細胞の薬剤応答の機構解明に有⽤な多くの情報が得られます。
インピーダンス測定メカニズム
CytoView-Z プレートの各well内には平面電極が埋め込まれています。電極上に細胞を播種し、インピーダンス(Ω)の変化を測 定することにより、細胞の増殖・形態変化・傷害等の評価が可能です。

インピーダンス(抵抗値)はWell内の各電極に微⼩電流を印加することによ り測定されます。電極上に細胞等の遮蔽物が無い場合、電流は容易に電極 を通過しインピーダンスは低くなります。⼀⽅、細胞等により電極が遮蔽 されると電流の電極通過量が減り、インピーダンスが上昇します。⽣細胞 の電極への付着・増殖・細胞間の結合等はインピーダンスを上昇させ、⼀ ⽅、細胞死による電極からの剥離等はインピーダンスを下降させます (右図参照)。
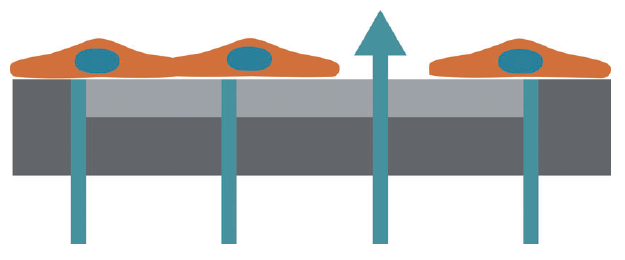
細胞の微量な構造変化もインピーダンスの変化で検知できます。Gタンパク質共益受容体等の受容体媒介のシグナリングや細胞 形態変化もインピーダンスの変化にて検出可能です。
細胞の増殖等に伴うインピーダンスの変化
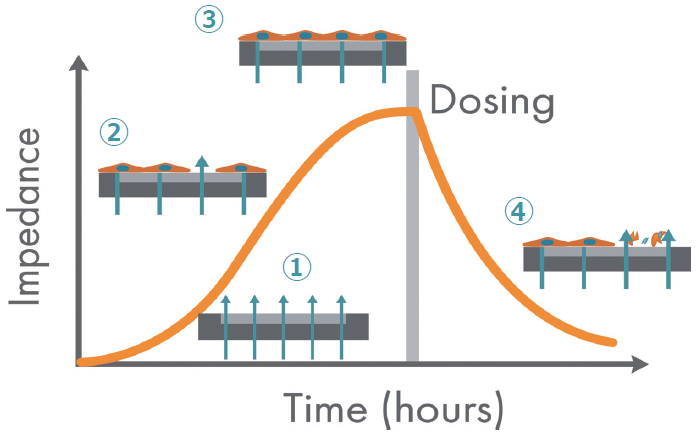
- 細胞の接着が無い状態のインピーダンスは低い
- 時間の経過と共に細胞が増殖し、電極が遮蔽さ れてインピーダンスが増加
- 細胞が電極全体を覆いConfluentな状態になる と、インピーダンスは均衡状態になる
- 薬物投与により一部の細胞が壊死し電極から剥 離するとインピーダンスは減少
Maestro Zシリーズによる測定
Maestro Z シリーズによるインピーダンス測定は極めて簡単です。以下の3ステップで測定可能です。
[1] CytoView-Z プレートに細胞播種・培養 [2] ボタン1つでプレートを装着・測定開始 [3] 専用ソフトでデータ記録・解析
Maestro Zシリーズではユーザーが実験環境設定・大量データの処理と解析等に煩わされることが無いようにシステム設計がなされ ています。測定は簡単なボタン操作とソフトウエア設定のみで行います。測定後の大量データ解析処理やグラフの作成も付属のソフ トを用いて容易に行えます。

MAESTRO Z シリーズの特徴

セミ・オートメーション
ハードウエアの操作はボタン1つで行います。ボタンを押 すと装置上部のスライドドアが開き、プレートを格納と同 時にデータ測定と温度、CO₂の制御を開始します。
アプリ対応
専用アプリの使用で、実験室の外からでもライブ実験デー タ、装置の状況が確認できます。
ラベル・フリーでの経時的測定
プレート底面に埋め込まれた平面電極を用いてインピーダンス を測定します。細胞にダメージを与えることなく、長期間に渡 りリアルタイムで細胞の増殖・形態変化等を測定できます。
ユーザーフレンドリーなソフトウエア
専⽤のソフトで、容易に実験設定が⾏えます。リアルタイム でシグナルのモニタリングも可能です。

インキュベータ不要
プレート格納部には温度・CO₂コントロール装置が搭載さ れ、ミニ・インキュベータになっています。プレート上で 細胞を培養しながら数⽇間から数週間、安定した状態での 測定が可能です。
SOFTWARE
Axis Z : リアルタイム・モニタリング ~解析表示まで
- 専用ソフトAxis Zで実験環境設定・データ測定・解析・解析結果のエクス ポートが可能です。
- 取得されたインピーダンスの変化をリアルタイムでグラフ表示します。
- Cytolysisのグラフ表示が可能です。
- 解析結果は.csvファイルでエクスポート可能です。
- 直観的で簡単な構成のソフトは、初心者の方にも安心してご利用頂けます。
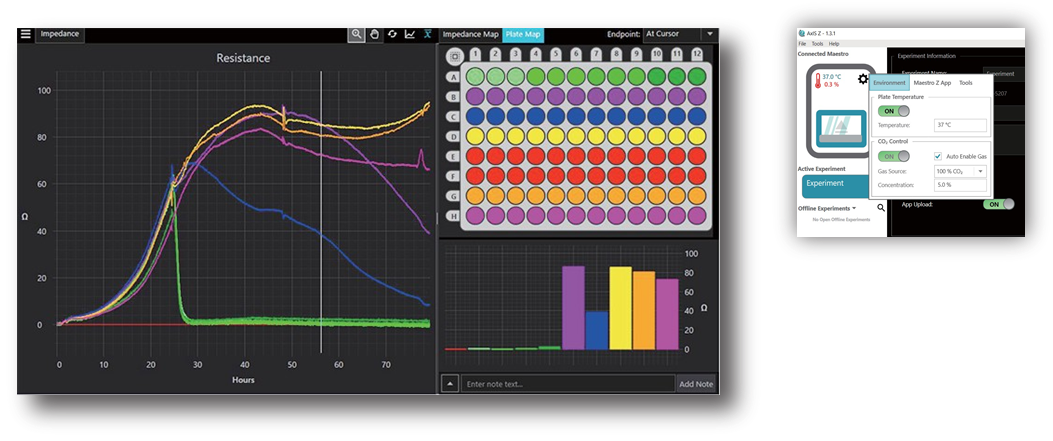
Maestro Z アプリ

- 専用モバイルアプリに対応しています。
- 実験室の外から、実験中のデータをリアルタイムで確認できます。

APPLICATIONS
がん免疫研究
T細胞によるがん細胞キリングアッセイ
T細胞を用いたがん治療は、その高い特異性と自然免疫を利用した方法であることから、新たながん治療の有効な手法の1つとして 注目を集めています。Maestro Zを用いて、がん細胞の増殖からT細胞等の免疫細胞によるキリングを、経時的に長期間測定するこ とが可能です。
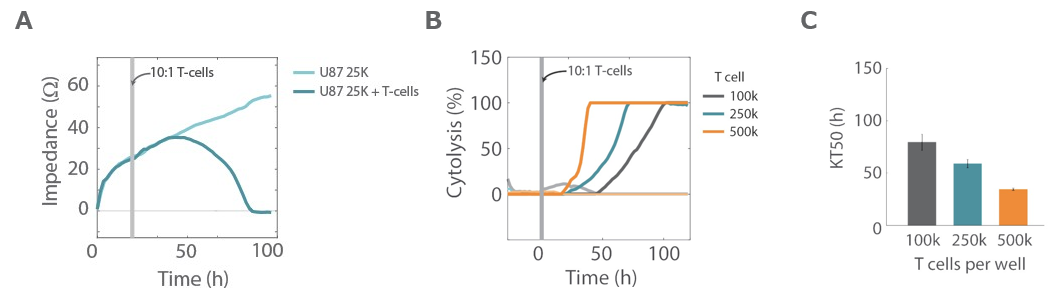
A: U87MG細胞(グリオーマ細胞)を用いて、T細胞による細胞傷害の試験を実施した。細胞播種24時間後に活性化したT細胞を加え、継続してインピ ーダンスを測定した。T細胞を添加した条件下では、インピーダンスの低下がみられた。
B, C: 3種類の細胞播種密度(100,000, 250,000, 500,000 cells/well)でのCytolysis率(細胞傷害率)を示す。T細胞とU87MG細胞との比率は一定(10:1) であるが、細胞播種密度に比例して細胞傷害性が高くなった(Kill timeが短くなった)。
Cytotoxisity (細胞傷害)
抗がん剤による細胞傷害アッセイ
Maestro Zによるインピーダンス測定試験では、薬剤等による細胞の傷害をラベルフリーで経時的に測定します。エンドポイントア ッセイのようなアッセイの繰り返しやアッセイポイントの変更は不要。一度の測定で細胞の傷害の全過程を測定し、重要なイベン トを見逃しません。
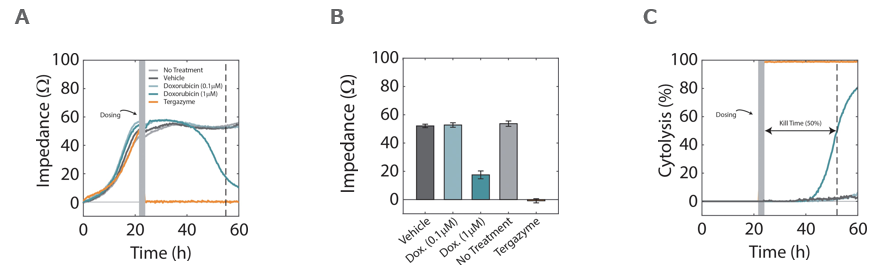
A: A549細胞をCytoView-Zプレートに播種し24時間後にドキソルビシン(水色) 、テルガザイム(オレンジ色) 、DMSO(グレー色) を添加、継続してイ ンピーダンスを測定した。テルガザイム投与の細胞インピーダンスは0になり(full cytolysis)、高濃度(1 uM) ドキソルビシン投与の細胞は時間の経過 と共にインピーダンスが減少した。
B: 薬剤投与30時間後 (A図点線箇所) のインピーダンスを示す。1μM ドキソルビシン投与によりインピーダンスの減少が見られ、その効果を示唆した。
C: テルガザイム投与(100% cytolysis)、薬剤非投与(0% cytolysis)を用いて算出された1 μM ドキソルビシン条件でのCytolysis率(細胞傷害率)を示す。 このグラフから、Kill Time 50%(50%細胞傷害到達時間)が約31時間であったと判別された。
TEER (経上皮電気抵抗)
細胞バリア機能評価
Maestro Zでは、内皮・上皮細胞のバリア変化の検出も可能です。細胞バリア機能の変化を、数日間に渡り安定した環境で測定で きます。ハイスループット・フォーマットのプレートで一度に多彩な検証が可能です。
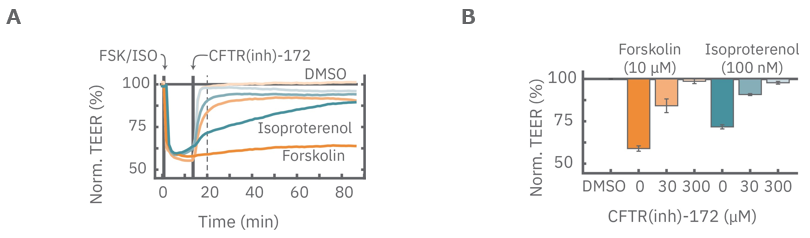
A: CytoView Zプレート上にCalu-3細胞を播種し、イソプレテレノール(100 nM、水色)、フォルスコリン (10 μM、オレンジ色)をそれぞれ投与し たところ、TEERは急激に減少した。続いてCFTR(inh)-172(胞性線維症膜コンダクタンス制御因子(CFTR)抑制剤) を30μM、300μMの異なる濃度 で投与したところ、TEERのリカバリーが見られ、そのリカバリー速度はCFTR(inh)-172の濃度に依存した (薄色線ほど高濃度を示す)。
B: CFTR(inh)-172投与から5分後 (A図点線箇所) のTEERを示す。その抑制作用は濃度に依存した。
ウィルス研究
抗ウィルス薬スクリーニング
ウィルスによる細胞壊死を数日間に渡り、リアルタイムで測定、定量化することが可能です。ウィルス感染価の検証や抗ウィ ルス薬の薬効評価、スクリーニングなどに有用です。
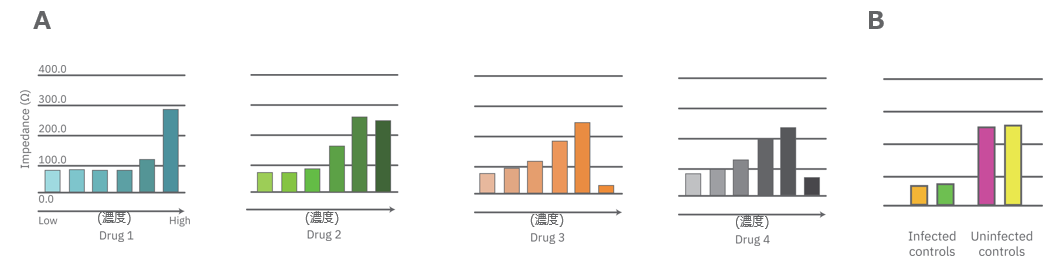
A: CytoView-Z プレート上にVero E6細胞を播種し、24時間後SARS-CoV-2ウィルスと抗ウィルス薬剤 (Drug 1, 2, 3, 4) を複数濃度で添加し、イ ンピーダンスを測定した。いずれの薬剤も、高濃度化ほど高いインピーダンス値 (細胞生存率)を示した。Drug3, 4の投与では、最高濃度で著し いインピーダンスの減少が得られ、強い細胞毒性が示唆された
B: コントロールのインピーダンスを表す。ウィルスのみ添加のVero E6細胞 (Infected controls) は低いインピーダンス (細胞死) を示し、ウィルス 非添加の細胞 (Uninfected controls) は高いインピーダンス(細胞生存)を示した
データ提供: Drs. Alex Jureka, Chris Basler, Georgia State University
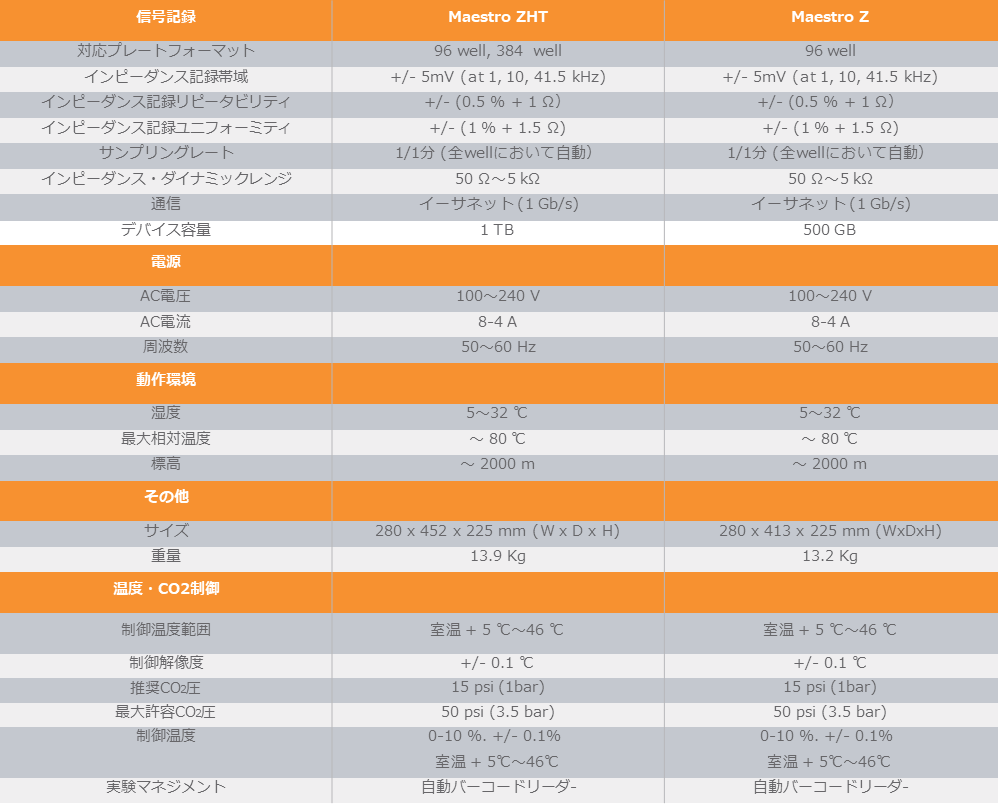
SPECIFICATIONS
仕様
プレート搭載部分(ミニインキュベータ部)

